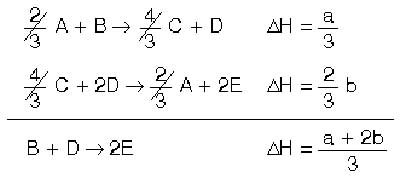Hess Kanunu
termokimyada ilk ve son haller prensibi olarak bilinen bir kanun. Bir kimyasal reaksiyon veren sistemin iki belirli hali arasında belirli bir enerji farkı vardır. Bu sebeple sistemin bir halden öbür hale geçmesiyle belirli bir miktar enerji alınır veya verilir. Bu enerji miktarı sistemin geçirdiği basamaklara bağlı değildir. Bu kanuna en basit misal karbonun çeşitli basamaklar üzerinde oksidasyonudur. Karbon havada yandığı zaman karbondioksit (CO2) verir
C + O2 › CO2 + 94050 kalori
Bu reaksiyonda bir mol CO2 başına 94050 kalori enerji açığa çıkar. Diğer taraftan karbon yarım mol
oksijen ile yüksek sıcaklıkta karbon monoksit (CO) verir:
C + 1/2 O2 › CO + 26840 kalori
Bu reaksiyonda açığa çıkan enerji bir mol CO başına 26840 kaloridir. O halde Hess Kanununa göre
eğer CO oksijenle CO2 vermek üzere yakılırsa çıkacak enerji yukarda geçen iki enerji arasındaki fark
kadar olur:
CO + 1/2 O2 › CO2 + 67610 kalori
Bu kanun bir ara basamaktaki enerjiyi hesapla bulmaya yarar.