Fluor Nedir
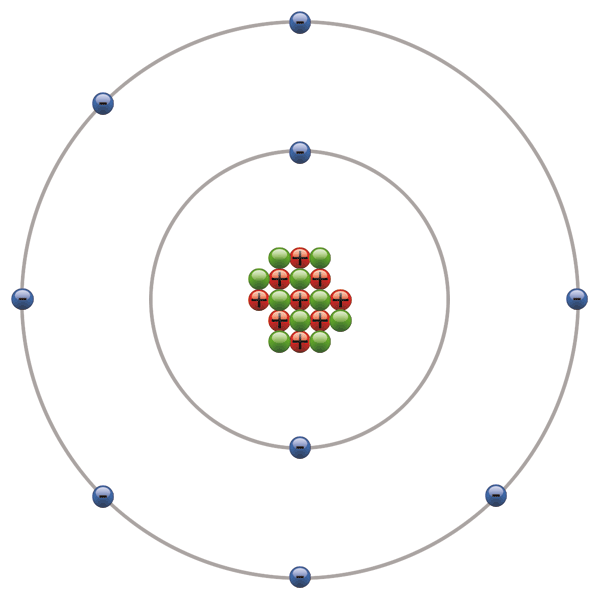 Sembolü F olan, reaksiyon verme kabiliyeti oldukça yüksek bir kimyasal element. Özellikleri Çürütme özelliği yüksek, zehirli, soluk sarı renkli, keskin kokulu gazdır. Peryodik cetvelde 7A grubunda bulunur. Halojenler sınıfının en küçük üyesidir. Atom numarası 9, atom ağırlığı 18,9984 tür. Serbest haldeyken iki atomlu moleküler yapıya sahib olup, formülü F2 dir. Molekül ağırlığı 37,9968dir. -219,62°Cda erir ve -188,14°Cde kaynar
Sembolü F olan, reaksiyon verme kabiliyeti oldukça yüksek bir kimyasal element. Özellikleri Çürütme özelliği yüksek, zehirli, soluk sarı renkli, keskin kokulu gazdır. Peryodik cetvelde 7A grubunda bulunur. Halojenler sınıfının en küçük üyesidir. Atom numarası 9, atom ağırlığı 18,9984 tür. Serbest haldeyken iki atomlu moleküler yapıya sahib olup, formülü F2 dir. Molekül ağırlığı 37,9968dir. -219,62°Cda erir ve -188,14°Cde kaynar
Fluor, elektron alma arzusu elektronegativite en büyük olan elementtir. Bazı soy gazlar hariç, bütün elementlerle birleşir. Oksijen ile verdiği bileşiklerde oksijen + değerlikli olur ki bu da fluorun elektron ilgisinin büyüklüğünü göstermektedir. Fluor atomunun çapı küçük olduğu için, bu derece elektron ilgisine sahiptir. Bunun sonucu olarak da birleştiği diğer elementleri alabileceği en yüksek değerliğe çıkartır.
Bulunuşu Fluor tabiatta bileşikler halinde olup, serbest halde bulunmaz. Tabiattaki elementlerin çokluğu bakımından on üçüncüdür. Başlıca fluor, kaynağı CaF2 fluorspat, Na3AlF6 buztaşı, kriyolit ve CaF2Ca3PO42 fluorapatitdir. Kriyolit ekonomik çapta Grönlandda bulunur. Fakat fluorspat dünyada çok geniş alana yayılmış haldedir.
Fluorapatit % 3,8 oranında fluor ihtiva eder ve fosfatlı kayalarda bol miktarda bulunur. Bu kaynak dünyanın en zengin fluor deposudur. Fluor suda milyonda 0,1-7 oranında bulunur.
Elde edilişi Fluor ilk olarak 1886 yılında potasyum fluorür çözeltisinin ve susuz hidrojen fluorürün elektrolizinden elde edildi. Bugün de elektroliz metodu ile elde edilir.
Kullanılışı fluorun, element halinde kullanılma alanı pek yoktur. Fakat fluordan başlayarak elde edilen bileşikler birçok alanda kullanılmaktadır. Mesela organik fluor bileşikleri soğutma teknolojisinde önemli yer tutmaktadır.
Bileşikleri Fluor oldukça aktif olduğundan, normal sıcaklıkta birçok metal ile fluorür bileşiklerini verir. Yalnız alüminyum, bakır ve nikel gibi metallerle meydana getirdiği fluorür bileşikleri, metal üzerinde bir film meydana getirir ki, bu film koruyucu bir tabaka özelliği gösterir.
Fluorun en önemli bileşiklerinden biri hidrojen fluorürdür. Formülü HF olup elementlerinden elde edildiği gibi, fluorür bileşiklerinden de elde edilir. Susuz veya çözelti halinde kullanılır. Sulu çözeltisine fluorür asidi denir. Susuz hidrojen fluorür, petrol sanayiinde yakıtların oktan oranını ayarlamak için katalizör olarak kullanılır. Ayrıca diğer fluorürlerin elde edilmesinde kullanılır. Cama etki eden tek asit olup, cam üzerine yazı yazmada kullanılır.
Fluor kendinin de dahil olduğu halojen grubu elementleri ile reaksiyon verir. Bunları + değerlikli yaparken kendisi – değerliklidir. Bu bileşiklerden bazıları, ClF3, ClF5, BrF3, IF5 ve IF7 dir. Ayrıca son zamanlarda oksijen ile bileşikleri de elde edilmiştir OF2, O2F2, O3F2 ve O4F2 gibi.
Anorganik bileşiklerinden en önemlisi uranyum ile meydana getirdiği uranyum hekzafluorürdür UF6. Bu bileşiğinden ve gazların diffüzyonu işleminden faydalanarak nükleer enerjide kullanılan uranyum 235 izotopu saflaştırılır. Sülfür hekzafluorür, formülü SF6 olup, kimyaca inert, zehirsiz, renksiz bir gazdır. Fevkalade bir gaz izolatör olup, yüksek gerilim cihazlarında kullanılır.
Antimon fluorürler SbF3, SbF5, bor trifluorür BF3, kükürt tetrafluorür SF4 ve halojenfluorürler, organik fluorür bileşiklerini elde etmek için fluorlandırma vasıtası olarak kullanılır. Fluor organik bileşiklerle karbon tetrafluorür CF4 hariç şiddetli reaksiyon verir. Reaksiyon şartlarını kontrol ederek ve azot gibi inert bir gaz ile seyreltilerek sadece karbon ve fluor ihtiva eden organik bileşikler elde etmek mümkündür. CF4 ve C7F16 gibi hidrokarbon benzerleri elde edilmiştir.
Organik bileşiklerinin çoğu susuz hidrojen fluorürden ve anorganik fluorürlerden elde edilir. Organik fluorür bileşiklerinin en önemlilerinden bazısı, soğutmada kullanılan diklor difluor metan CF2Cl2 ve plastik teflon imalatında kullanılan tetrafluor etilen C2F4dir. Bundan başka halkalı yapıdaki C4F8 aerosol püskürtücü olarak, CF3Br ve CF2Br yangın söndürme cihazlarında kullanılmaları bakımından önemlidir.
Fluorun biyolojk önemi Vücudun diş ve kemik gibi bazı dokularında fluor elementinin yeterince depolanmaması halinde fluor eksikliği tabir edilen bir takım rahatsızlıklar doğar. Yapılan bazı incelemeler çürümüş bir dişteki fluor miktarının sağlam diştekine göre düşük olduğunu göstermiştir. Ayrıca çocuklarda raşitizm hastalığının fluor eksikliği durumunda daha çok ortaya çıktığı ifade edilmektedir.
Vücudun ihtiyacı olan fluor miktarı içme sularında mevcuttur. içme suları ve yiyeceklerle alınan fluorür miktarı ihtiyaç duyulan seviyededir. Ayrıca fluorürlerin ağızdan çok fazla miktarda alınması da fluor zehirlenmesine yol açar. Fluor ihtiva eden sanayilerde çalışan işçilerde kronik fluor zehirlenmesi görülebilir.



